PRODYGY : essai « first-in-human » de thérapie génique du facteur de viabilité des cônes dérivé des bâtonnets (RdCVF) dans la dystrophie bâtonnets-cônes
Prof. Isabelle Audo — Amphithéâtre Havane — Jeudi 4 septembre — Session “Free Paper 2 – Inherited Retinal Diseases”
Écrit par Aliénor Vienne-Jumeau
Contexte
La dystrophie rétinienne bâtonnets-cônes (RCD) se caractérise par une dégénérescence initiale des bâtonnets suivie d’une perte secondaire des cônes. SPVN06 est une thérapie génique mutation-agnostique qui vise à protéger et soutenir les cônes grâce à l’expression combinée de facteurs dérivés des bâtonnets. L’administration se fait par injection sous-rétinienne unique.
Mécanisme d’action
SPVN06 est un AAV incluant un transgène codant pour RdCVF et RdCVFL, dont l’action est synergique et indépendante de la cause moléculaire de la dystrophie rétinienne bâtonnets-cônes
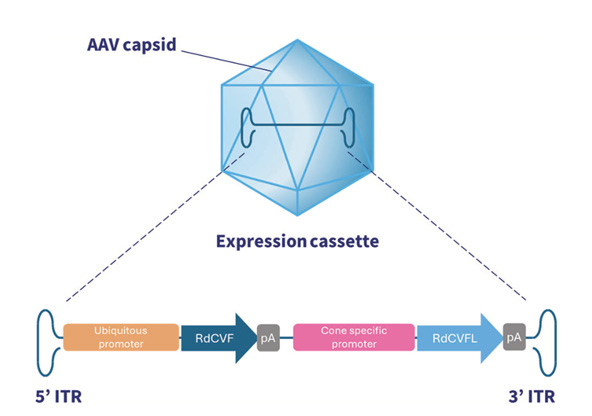
Marie et al., Gene Therapy, 2025
- RdCVF stimule le métabolisme du glucose dans les cônes et favorise ainsi le renouvellement de leurs segments externes.
- RdCVFL atténue le stress oxydatif qui s’accroît dans les cônes après la mort des bâtonnets.
- Ensemble, ces deux protéines visent à préserver la viabilité et la fonction des cônes.
Objectif
Cet essai de phase I/II, first-in-human et international multicentrique, a pour objectif principal d’évaluer la sécurité et la tolérance de SPVN06 douze mois après une injection sous-rétinienne unilatérale assortie d’un schéma d’immunomodulation péri-opératoire. L’évaluation porte sur l’ensemble des événements indésirables oculaires et systémiques, y compris les événements liés à la procédure et, lors de l’escalade de dose (Étape 1), la survenue d’éventuelles toxicités limitant la dose.
Les objectifs secondaires visent à :
- Caractériser la sécurité et la tolérance à long terme jusqu’à cinq ans après l’injection ;
- Décrire l’immunogénicité et la biodissémination ;
- Recueillir des signaux d’efficacité préliminaires.
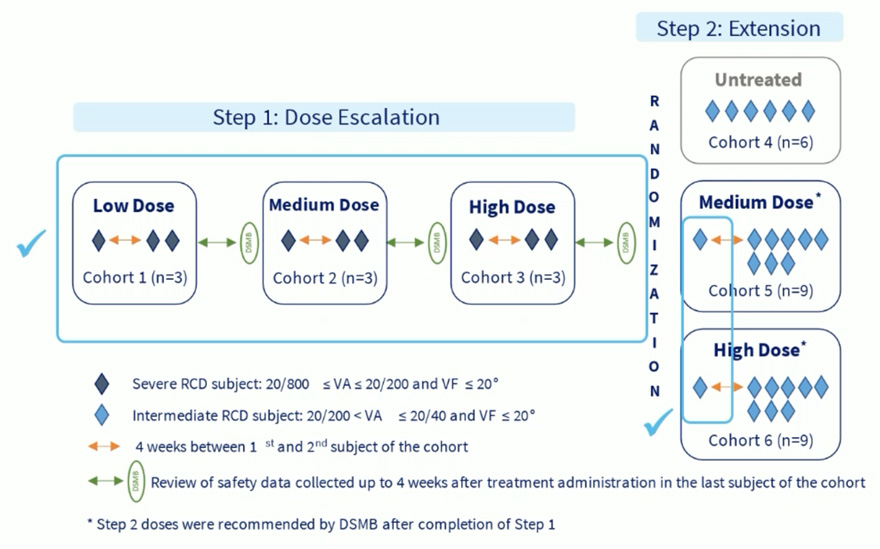
Plan d’étude
L’étude comporte deux étapes :
– Étape 1 (9 patients) : escalade de dose (faible → intermédiaire → élevée) en ouvert, avec comparaison œil traité versus œil controlatéral non traité.
– Étape 2 (24 patients prévus) : extension contrôlée, randomisée en double insu, planifiée après l’examen de sécurité de l’étape 1 permettant de sélectionner les 2 doses étudiées (intermédiaire et élevée).
Résultats de sécurité et tolérance
Les inflammations intraoculaires observées dans les yeux traités ont été faibles et transitoires. Aucune toxicité limitante de dose n’a été rapportée au cours de l’escalade. Sur le plan immunologique, il n’a pas été mis en évidence de réponse cellulaire dirigée contre les transgènes ni de réponse humorale persistante cliniquement significative ; aucun bolus stéroïdien n’a été requis. La majorité des événements indésirables étaient attendus et liés à la procédure, et ils ont été maîtrisés par la prise en charge standard.
Des anticorps anti-capside sont apparus chez certains sujets après l’injection, avec un pic précoce autour de M1 mais une décroissance aux visites suivantes. Aucune relation dose–réponse claire n’a été mise en évidence entre les doses faible, intermédiaire et élevée quant à l’intensité de la réponse humorale. Parallèlement, aucune réponse immunitaire cellulaire dirigée contre la capside ou les peptides des transgènes n’a été détectée, et aucune réponse humorale significative n’a été observée contre les deux produits transgéniques, RdCVF et RdCVFL.
Et donc au total…
SPVN06 présente un profil de sécurité favorable lors de l’escalade de dose et s’appuie sur une biologie solide : RdCVF soutient le métabolisme énergétique des cônes tandis que RdCVFL en réduit le stress oxydatif, ce qui peut préserver la fonction des cônes indépendamment du gène causal. Ce programme est prometteur pour des RCD hétérogènes, où les approches ciblant un seul gène sont limitées. Aucun signal de sécurité inattendu n’a été identifié à ce jour ; l’étape 2 doit maintenant déterminer la dose optimale et documenter l’efficacité.





